CBSE
 Multiple Choice Questions
Multiple Choice Questions1.7700
0.0344
0.0177
0.1770
37.25 %
32.25 %
30 %
35 %
0.4 M
1.2 M
1.8 M
0.5 M
308K તાપમાને 98 % વજનથી H2SO4 ધરાવતા અને 1.84 ગ્રામ મિલિ-1 ઘનતા ધરાવતા H2SO4 ના દ્વાવણની મોલારિટી કેટલી હશે ?
4.18 M
8.14 M
18.4 M
1.8 M
 ગ્લુકોઝના જલીય દ્વાવણમાં ગ્લુકોઝના મોલઅંશ કેટલા થશે ?
ગ્લુકોઝના જલીય દ્વાવણમાં ગ્લુકોઝના મોલઅંશ કેટલા થશે ?
0.021
0.017
0.1
0.18
0.5 M H2SO4 નું જલીય દ્વાવણ 0.5 m H2SO4 ના જલીય દ્વાવણ કરતાં વધુ સાંદ્વ્ર હોય, તો તે દ્વાવણની ઘનતા (d) કઈ શક્ય છે ?
1.07 ગ્રામ મિલિ-1
1.05 ગ્રામ મિલિ-1
1.06 ગ્રામ મિલિ-1
1.04 ગ્રામ મિલિ-1
 1020 અણુઓ હોય, તો યુરિયાના દ્વાવણની સાંદ્વતા કેટલી થશે ?
1020 અણુઓ હોય, તો યુરિયાના દ્વાવણની સાંદ્વતા કેટલી થશે ?0.01 M
0.001 M
0.2 M
0.1 M
 નું દ્વાવણ અને 15 %
નું દ્વાવણ અને 15 %  દ્વાવણ ભેગા કરવાથી બનતા મિશ્ર દ્વાવનની મિલારિટી (m) કેટલી થશે ? (NaOH નું આણ્વિય દળ = 40 ગ્રામ મોલ-1)
દ્વાવણ ભેગા કરવાથી બનતા મિશ્ર દ્વાવનની મિલારિટી (m) કેટલી થશે ? (NaOH નું આણ્વિય દળ = 40 ગ્રામ મોલ-1)
5.5 m
9.0 m
4.0 m
12.74 m
1.25 ગ્રામ લિટર-1
1.15 ગ્રામ લિટર-1
1.35 ગ્રામ લિટર-1
1.45 ગ્રામ લિટર-1
A.
1.25 ગ્રામ લિટર-1
દ્વાવણની મોલારીટી 11.5 છે. એટલે કે 1 લિટર દ્વાવણમાં H2SO4 ના 11.5 મોલ ઓગાળેલા છે.
ધારો કે 1 લિટર દ્વાવણમાં તેની ઘનતા d ગ્રામ મિલિ-1 છે એટલે કે 1000 મિલિ દ્વાવણ = 1000 d ગ્રામ નું 1000 ગ્રામ દ્વાવણ = 11.5 મોલ
નું 1000 ગ્રામ દ્વાવણ = 11.5 મોલ 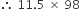 ગ્રામ = 1127 ગ્રામ
ગ્રામ = 1127 ગ્રામ
 પાણીનું દળ = (1000 d - 1127) ગ્રામ
પાણીનું દળ = (1000 d - 1127) ગ્રામ  મોલાલિટી =
મોલાલિટી = 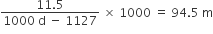
અથવા
અથવા
94500 d = 11500 + 1065101.5 = 118001.5 ગ્રામ લિટરે-1
ગ્રામ લિટરે-1
દ્વાવણની મોલારીટી 11.5 છે. એટલે કે 1 લિટર દ્વાવણમાં H2SO4 ના 11.5 મોલ ઓગાળેલા છે.
ધારો કે 1 લિટર દ્વાવણમાં તેની ઘનતા d ગ્રામ મિલિ-1 છે એટલે કે 1000 મિલિ દ્વાવણ = 1000 d ગ્રામ નું 1000 ગ્રામ દ્વાવણ = 11.5 મોલ
નું 1000 ગ્રામ દ્વાવણ = 11.5 મોલ 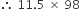 ગ્રામ = 1127 ગ્રામ
ગ્રામ = 1127 ગ્રામ
 પાણીનું દળ = (1000 d - 1127) ગ્રામ
પાણીનું દળ = (1000 d - 1127) ગ્રામ  મોલાલિટી =
મોલાલિટી = 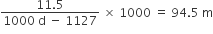
અથવા
અથવા
94500 d = 11500 + 1065101.5 = 118001.5 ગ્રામ લિટરે-1
ગ્રામ લિટરે-1
6M HCl ના 250 મિલ દ્વાવણને 3M HCl ના 650 મિલી દ્વાવણમાં ઉમેરીને મિશ્ર દ્વાવણ બનાવવામાં આવેલ છે. જો આ મિશ્ર દ્વાવણની મોલારિટી 3M કરવી હોય, તો તેમાં કેટલું પાણી ઉમેરવું પડે ?
575 મિલિ
500 મિલિ
250 મિલિ
1150 મિલિ