CBSE Gujarat Board Haryana Board
Class 10 Class 12

સૌપ્રથમ કયા વૈજ્ઞાનિકે સંકીર્ણ સંયોજનોનો સિદ્વાંત આપ્યો ?
શ્રોડિન્જર
ઑગસ્ટ હૉફમૅન
આલ્ફ્રેડ વર્નર
સંકીર્ણ સંયોજનોમાં લીગેન્ડનો સ્વભાવ કયો છે ?
લુઇસ બેઇઝ
લુઇસ ઍસિડ
આર્હેનિયસ ઍસિડ
ટુંક નોંધ લખો.
(i) આંતરાલીય સંયોજનો
(ii) મિશ્રધાતુઓ
(iii) લેન્થેનાઇડ તત્વોની રાસાયણિક પ્રક્રિયાત્મકતા
(iv) લેન્થેનાઇડ
(i) આંતરાલીય સંયોજનો :
સંક્રાંતિ ધાતુઓની ઘન સ્થિતિમાં પરમાણુઓ ચોક્ક્સ સ્ફટિક રચનામાં ગોઠવાયેલા હોય છે. આવી ગોઠવનીમાં પરમાણુઓ વચ્ચે ચોક્કસ પોલાણ હોય છે. તેથી નાના કદના અધાતુ પરમાણુ જેવા કે H, C, N, અને B સ્ફટિક રચનાનાઅ પોલાણમાં સહેલાઇથી ગોઠવાય છે. આ રીતે બનેલાં સંયોજનોને આંતરાલીય સંયોજનો કહે છે.
પોલાણમાં ગોઠવાયેલા નાના કદના અધાતુ પરમાણુઓ અને ધાતુ પરમાણુઓ વચ્ચે રાસાયણિક બંધ બનતો નથી. તેથી આવાં સંયોજનોમાં ઘટકોનું પ્રમાણ નિશ્વિત હોતું નથી. તેથી આંતરાલીય સંયોજનો હકીકતમાં બીનપ્રમાણ અથવા બિનતત્વયોગમિયીય સંયોજનો છે. TiH1.7, VH0.56 વગેરે.
આંતરાલીય પોલાણમાં ગોઠવાયેલા અધાતુ પરમાણુને આધારે તેમને હાઇડ્રાઇડ, કાર્બાઇડ, નાઇટ્રાઇડ અને બોરાઇડમાં વર્ગીકૃત કરી શકાય છે. કારણ કે હાઇડ્રોજન, કાર્બન, નાઇટ્રોજન અને બોરોન જેવાં તત્વો આંતરાલીય સ્થાનમાં ગોઠવાઇ શકે છે.
સ્ફટિક રચનાના પોલાણમાં ગોઠવાયેલા H, C, N અને B જેવા અધાતુ પરમાણુઓની હાજરીને લીધે ધાતુના લાક્ષણિક ગુણધર્મોમાં નોંધપાત્ર ફેરફાર જોવા મળે છે. અહીં, પોલાણમાં રહેલા નાના કદના અધાતુ પરમાણુ ધાત્વિક બંધના મુક્ત ઇલેક્ટ્રૉનને આકર્ષે છે. તેથી ધાત્વિક બધના મુક્ત ઇલેક્ટ્રૉન સ્થગિત થવાથી બંધની પ્રબલતા વધે છે. તેથી ધાતુના ગુણધર્મો જેવા કે સખતાઇ, ઘસારાનો પ્રતિકાર, ક્ષારણનો પ્રતિકાર, ગલનબિંદુ વગેરે જેવામાં નોંધપાત્ર વધારો થાય છે. આથી આંતરાલીય સંયોજનોનો ઉપયોગ ઓજારો, યંત્રસામગ્રી, વાહનો બનાવવામાં થાય છે.
આવા પ્રકારનાં સંયોજનોને ચોક્કસ આણ્વીય સૂત્રો હોતાં નથી. VN. Fe3c, Cr3C2, Mn3C. TiC, VB, CrB2 આંતરાલીય સંયોજનો છે.
(ii) મિશ્રધાતુઓ :
સંક્રાતિ તત્વોની પ્રથમ શ્રેણીના Cr, Mn, Fe, Co, Ni, Cu ધાતુઓના પરમાણ્વીય કદ વચ્ચેનો તફાવત 2% કરતાં પણ ઓછો છે. આ તત્વોના સંયોજકતા કોષની ઇલેક્ટ્રૉનીય રચનામાં તફાવત પ્રમાણમાં ઘણો ઓછો છે. તેથી આ તત્વો તેમના જુદા જુદા પ્રમાણવાળી સંખ્યાબંધ મિશ્રધાતુઓ બનાવે છે, જે વ્યવહારમાં ખૂબ જ જુદા જુદા પ્રમાણવાળી સંખ્યાબંધ મિશ્રધાતુઓ બનાવે છે, જે વ્યવહારમાં ખૂબ જ ઉપયોગી છે. કેટલીક અગત્યની મિશ્રધાતુઓ, તેમના ઘટકો, ગુણધર્મો અને ઉપયોગો નીચેના કોષ્ટક માં દર્શાવેલ છે.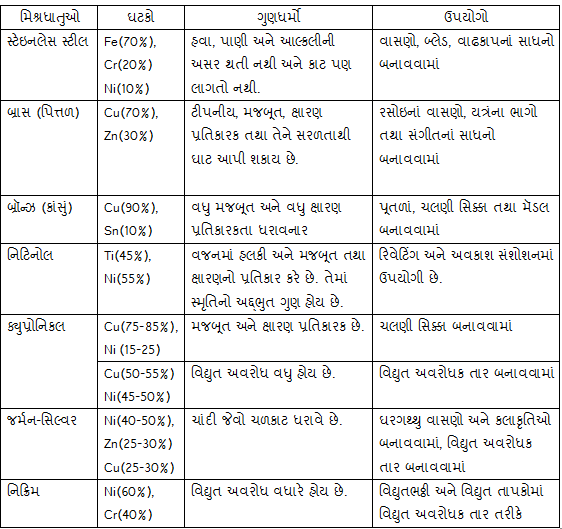
આ ઉપરાંત મરક્યુરી સાથેનો એમાલ્ગમ મિશ્રધાતુ પણ ખૂબ પ્રચલિત છે. આ મિશ્રધાતુમાં Hg(50%), Ag(35%), Sn(12%), Cu(3%) અને Zn(૦.2%) હોય છે. આ મિશ્રધાતુનો ઉપયોગ દાંતના પોલાણ પૂરવા માતે કરવામાં આવે છે. જ્યારે દાંતના પોલાણમાં આ મિશ્રધાતુને ભરવાની હોય તેના થોડા સમય પહેલા જ બધી ધાતુઓને મિશ્ર કરવામાં આવે છે. આ મિશ્રધાતુ મૃદુ હોય છે અને અનુકૂળ રહે છે. આ મિશ્રધાતુ પોલાણમાં ભરાયા બાદ કઠિન બને છે તથા તેનું વિસ્તરણ વધુ થતું નથી.
(iii) લેન્થેનાઇડ તત્વોની રાસાયણિક પ્રક્રિયાત્મકતા
લેન્થેનૉઇડસ (+3) ઑક્સિડેશન અવસ્થા ધરાઅવતા હોવાથી તેઓ Ln(OH)3 પ્રકારના હાઇડ્રૉક્સાઇડ બનાઅવે છે. આ હાઇડ્રૉક્સાઇડ, Ca(OH)2 થી ઓછા પરંતુ AI(OH)3 કરતાં વધુ બેઝિક છે. કૅલ્શિયમ ગરમીથી તેમના ઑક્સાઇડમાં જલદીથી વિઘટન થાય છે. Ce3+થી Lu3+ તરફ જતાં આયનોનું કદ ઘટે છે. તેથી તેમની બેઝિકતા ઘટતી જાય છે. એટલે કે Ce(OH)3 સૌથી વધુ બેઝિક અને Lu(OH)3 સૌથી ઓછું બેઝિક છે. આ તત્વો તેમના રાસાયણિક બેઝિકતામાં રહેલા તફાવતને આધારે કરવામાં આવે છે. આ તત્વોના Ln2O3 પ્રકારના ઑક્સાઇડ પણ જાણીતા છે, જે આયનીય અને બેઝિક છે. આયનીય કદના ઘટાડાની સાથે બેઝિકતાનો ગુણ ઘટે છે. આ તત્વોનો કેટલાક આયનો f-કક્ષકના અયુગ્મિત ઇલેક્ટ્રૉનને લીધે અનુચુંબકીય ગુણ ધરાવે છે. તેમના કેટલાક આયનો રંગીન દ્વાવણો આપે છે. લેન્થેનૉઇડસની સામાન્ય રાસાયણિક પ્રક્રિયાઓ નીચે દર્શાવેલ છે :![]() જ્યાં Ln = લેંથેનાઇડ શ્રેણીનાં તત્વો
જ્યાં Ln = લેંથેનાઇડ શ્રેણીનાં તત્વો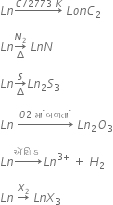
(iv) લેન્થેનાઇડ :
આવર્ત કોષ્ટકના કોઈ પણ આવર્તનાં તત્વોની જેમ લેન્થેનાઇડ શ્રેણીનાં તત્વોમાં સિરિયમ (Ce) થી લુટેશિયમ (Lu) તરફ જતાં પરમાણ્વીય ત્રિજ્યા અને આયનીય ત્રિજ્યા ઘટતી જાય છે. આ શ્રેણીનાં તત્વોમાં પરમાણ્વીય ક્રમાંક વધવાની સાથે નવા ઇલેક્ટ્રૉનનો ઉમેરો છેલ્લી કક્ષાને (n=6) બદલે અંદરની કક્ષા 4f(n=4) માં થાય છે. તેથી કેન્દ્વમાં વધતાં ધન વીજભાર પ્રત્યે 4f-કક્ષકમાં રહેલા ઇલેક્ટ્રૉન વધુ આકર્ષણ ધરાવે છે. તેથી પરમાણુનું સંકોચન થાય છે, એટલે કે પરમાણ્વીય ત્રિજ્યા ઘટે છે. લેન્થેનાઇડ તત્વોમાં થતાં આ સંકોચનને લેન્થેનાઇડ સંકોચન કહે છે. લેન્થેનાઇડ સંકોચનની, લેન્થેનાઇડ શ્રેણી પછીનાં તત્વોની પરમાણ્વીય ત્રિજ્યા પર અસર જોવા મળે છે. લેંથેનાઇડ શ્રેણી પછીનાં તૃતીય સંક્રાંતિ શ્રેણીનાં કેટલાક તત્વોની પરમાણ્વીય ત્રિજ્યાઓ આ શ્રેણીની અગાઉની દ્વિતીય સંક્રાંતિ શ્રેણીનાં તત્વોની ત્રિજ્યા જેટલી હોય છે, જે નીચેના કોષ્ટક પરથી સમજી શકાય છે.
દ્વીતીય અને તૃતીય સંક્રાંતુઇ શ્રેણીનાં તત્વોની પરમાણ્વીય ત્રિજ્યા (Pm)
સંકીર્ણ સંયોજનોમાં L![]() M કયા પ્રકારનો બંધ હોય છે ?
M કયા પ્રકારનો બંધ હોય છે ?
ધાત્વીક
સવર્ગ-સહસંયોજક
સહસંયોજક
નીચેનામાંથી કોણ લીગેન્ડ તરીકે વર્તી શકે નહી ?
H2O
NO3-
CO2
CO